Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.

* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда:
(I) 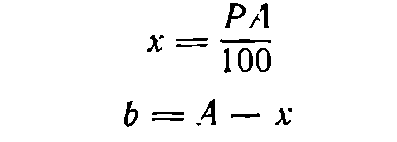
(2)
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
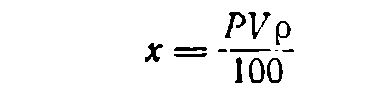
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4) 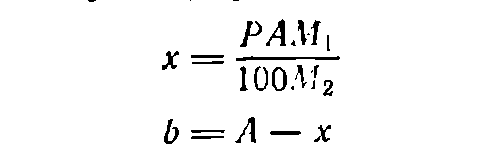
(5)
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
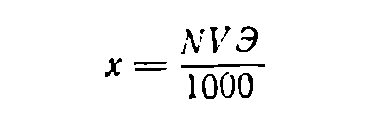
(6)
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
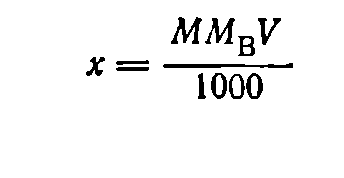
(7)
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(9) 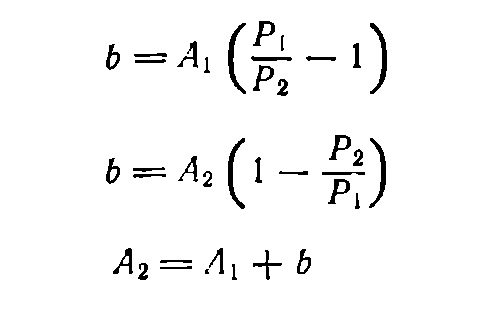
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
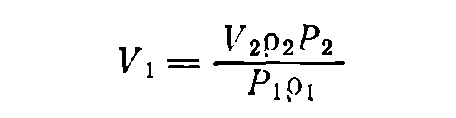
(11)
Объем воды (в мл) для разбавления: b = V2 — V1
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
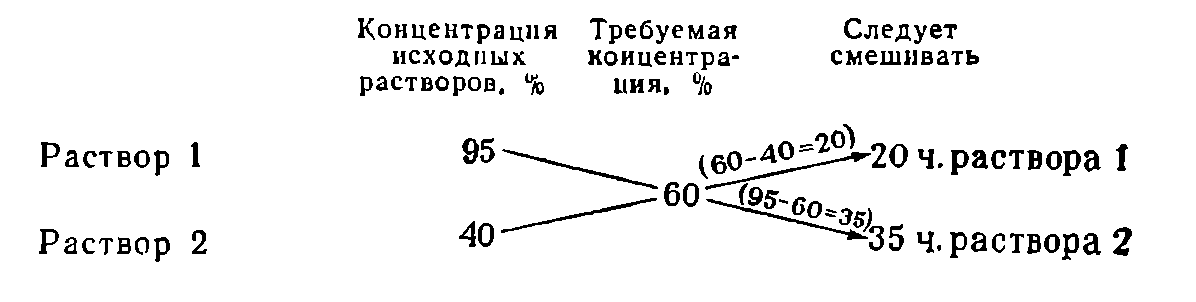
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:

Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%: 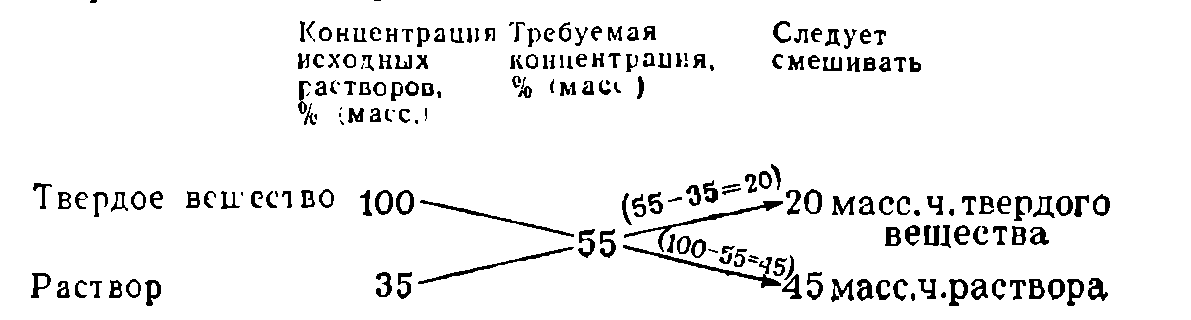
Формулы пересчета концентрации растворов
Обычно растворы приготовляются с весовой, молярной и эквивалентной концентрацией. В таблице приведены формулы пересчета для наиболее употребительных растворов. В формулах учитывается, что для одинаковых температур и обычной точности измерений числовые значения относительного веса, плотности (г/см 3 ) и удельного веса (г/см 3 ) практически совпадают.
Весовые концентрации
| Искомая | Св%, г/100 г раствора | Св.в, /100г растворителя | Св.о., г/дм 3 раствора |
| Заданная | |||
| Св,% | Св% | 100·Св (100-Св) | 10·ρ·Св |
| Св.в., г/100г | 100·Св.в 100+Св.в. | Св.в. | 1000·ρ·Св.в. 100+Св.в. |
| Св.о., г/дм 3 | Св.о. 10·ρ | 100·Св.о. 1000·ρ-Св.о. | Св.о. |
| См.д. | 100·См.д.·М См.д.М+(1-См.д.)Мр | 100См.д.М (1-См.д.)Мр | 1000ρСмд·М См.д.М+(1-См.д.)Мр |
| Сm., моль/1000г | 100СmМ 1000+Сm·М | Сm·М | 1000ρСmМ 1000+СmМ |
| См, моль/дм 3 | См·М 10ρ | 100См·М 1000ρ-См·М | 100См·М 1000ρ-См·М |
| Сн, моль-эк/дм 3 | Сн·Мэ 10ρ | 100Сн·Мэ 1000ρ-Сн·Мэ | 100Сн·Мэ 1000ρ-Сн·Мэ |
Молярные концентрации
| Искомая | См.д. | Сm, моль/1000г | См, моль/дм 3 |
| Заданная | |||
| Св,% | Св/ М Св+ 100-Св М Мр | 1000Св М(100-Св) | Св10ρ М |
| Св.в., г/100г | Св.в./ М Св.в. + 100 М Мр | 10С.в.в М | 1000ρСв.в (100+Св.в.)М |
| Св.о., г/дм 3 | Мр·Св.о Св.о.(Мр-М)+1000ρМ | 1000·Св.о. М(1000ρ-Св.о | Св.о. М |
| См.д. | См.д. | 1000См.д. Мр-См.д.·Мр | 1000См.д. См.д.М+(1-См.д.)Мр |
| Сm., моль/1000г | Мр·Сm Мр·Сm+1000 | Сm | 1000ρ·Сm 1000+Cm· M |
| См, моль/дм 3 | Мр·См См(Мр-М)+1000ρ | 1000См 1000ρ-См·М | См |
| Сн, моль-экв/дм 3 | Сн·Мэ·Мр Сн·Мэ(Мр-М)+1000ρМ | 1000Сн·Мэ (1000ρ-Сн·Мэ)М | Сн·Мэ М |
Эквивалентные концентрации
| Искомая | Сн, моль-экв/дм 3 | Сэ.в., моль-экв/1000г |
| Заданная | ||
| Св,% | Св·10ρ/Мэ | 1000Св/Мэ(100-Св) |
| Св.в., г/100г | 1000ρСв.в. (100+Св.в.)Мэ | 10Св.в. Мэ |
| Св.о., г/дм 3 | Св.о./Мэ | 1000Св.о./(1000-Св.о.)Мэ |
| См.д. | 1000ρ·См.д.·М [См.д.М+(1-Cм.д.)]Мэ | 1000См.д.·М (Мр-См.д.·Мр)Мэ |
| Сm., моль/1000г | 1000ρСmМ (1000+Сm·М)Мэ | См.д.·М Мэ |
| См, моль/дм 3 | См·М Мэ | 1000См·М (1000ρ-См·М)Мэ |
| Сн, моль-эк/дм 3 | Сн | 1000Сн/1000ρ-Сн·Мэ |
Св,% — весовая концентрация: показывает число грамм растворенного вещества в 100 граммах раствора;
Св.в. — весовая концентрация: показывает число грамм растворенного вещества в 100 г растворителя;
Св.о.- весо-объемная концентрация: показывает число грамм растворенного вещества в 1 литре раствора;
См.д.-мольная доля: число молей растворенного вещества на количество молей в растворе;
Сm — молярно-весовая концентрация или моляльность: показывает число молей растворенного вещества в 1 кг растворителя;
См — молярно-объемная или моляльность: показывает число молей растворенного вещества в 1 дм 3 раствора;
Сн — эквивалентно-объемная или нормальность: показывает число моль-эквивалентов растворенного вещества в 1дм 3 раствора;
Сэ.в. — эквивалентно-вессовая: показывает число грамм-эквивалентов растворенного вещества в 1кг растворителя;
М — молярная масса растворенного вещества;
Мр — молярная масса растворителя;
Мэ — молярная масса эквивалента растворенного вещества;
ρ — плотность раствора.
Формулы и зависимости, используемые
При приготовлении растворов
1. Растворение вещества в растворителе:
х = Св·а/100; b= а — х,
где х — масса растворяемого вещества, необходимая для приготовления заданного количества (а) раствора с требуемой весовой концентрацией в % (Св); b — масса растворителя.
При растворении кристаллогидрата в воде необходимо учитывать, что содержащаяся в нем кристаллизационная вода разбавляет раствор. Тогда используется формула:
х= Св.в.·z/1-(Св.в.(z-1)/100),
где Св.в. — заданная концентрация безводного вещества в растворе в г на 100 г воды; х -масса кристаллогидрата, которую следует растворить в 100 г воды, чтобы приготовить раствор с концентрацией Св.в., z-отношение М1/М (М1 и М — молекулярные массы кристаллогидрата и безводного вещества соответственно)
2. Разбавление раствора растворителем:
х=b(1-n/m); х = а(m/n-1); b=а + х,
где х -масса растворителя, необходимая для разбавления а единиц массы раствора с данной концентрацией (m вес. %) до требуемой (n вес. %); b-масса раствора после разбавления.
3. Концентрирование раствора выпариванием:
х = а(n-m)/n; а = х +b,
где х -масса растворителя, которую необходимо выпарить из а единиц массы раствора с данной концентрацией (m вес. %), чтобы получить раствор с требуемой концентрацией (n вес. %), n>m; b-масса раствора после выпаривания растворителя.
4. Смешение двух растворов с различной концентрацией:
а=с(l-n)/(m-n)=b(l-n)/(m-l); b=а(m-l)/(l-n)=c(m-l)/m-n; с =a+b,
где а — масса раствора с концентрацией m; b — масса раствора с концентрацией n; m и n — концентрации в растворах(в вес. %) до смешения, m>n; с — масса смеси с концентрацией l; l — требуемая концентрация растворенного вещества в смеси (вес. %).
5. Смешение двух растворов различных веществ:
а = m′·c/m; b=n′·c/n; а +b=с
m=m′·c/a; n=n′·c/b; n′=b·n/c; m′ +n′ +l=100,
где а и b — соответственно массы раствора вещества А и раствора вещества В, необходимые для приготовления смеси; m и n — концентрации раствора вещества А (вес. % А) и раствора вещества В (вес. % В); m′ и n′ — процентное содержание вещества А и вещества В в смеси; l — процентное содержание растворителя в смеси.
6. Правило смешения(«правило креста»):
Применяется для упрощения расчетов в случае приготовления раствора заданной концентрации (в вес. %) путем разбавления растворителем или смешения двух растворов.
Заданная концентрация раствора пишется в месте пересечения двух линий, а концентрации исходных растворов (для растворителя она равна нулю) — у концов обеих линий слева. Затем для каждой линии производится вычитание одного стоящего на ней числа из другого и разность записывается у свободного конца той же линии. Направление вычислений указывается стрелками. Полученные числа располагают у концов соответствующей линии справа. Они указывают, сколько единиц массы каждого раствора следует взять, чтобы получить раствор с заданной концентрацией:








А) Для получения 25%-ного раствора из 50 %-ного и 10 %-ного следует взять 15 единиц массы 50 %-ного раствора и 25 единиц массы 10%-ного.
Б) Для разбавления 50%-ного раствора до 25%-ного следует взять 25 единиц массы 50%-ног раствора и 25 единиц массы растворителя.
Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества
Количество и концентрация вещества. Выражение и пересчеты из одних единиц в другие. Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества.
6,022х10 23 атомов углерода (постоянная Авогадро = число Авогадро), то моль– такое количество вещества, которое содержит 6,022х10 23 структурных элементов (молекул, атомов, ионов и др.).
- Отношение массы вещества к количеству вещества называют молярной массой.
- M (X) = m (X) / n(X)
- То есть, молярная масса(М) – это масса одного моля вещества. Основной системной (в международной системе единиц СИ) единицей молярной массы является кг/моль, а на практике – г/моль. Например, молярная масса самого легкого металла лития М (Li) = 6,939 г/моль, молярная масса газа метана М (СН4) = 16,043 г/моль. Молярная масса серной кислоты рассчитывается следующим образом M (Н2SО4) = 196 г / 2 моль = 96 г/моль.
- Молярная масса М (Х) — масса одного моля молекул вещества (г/моль). M(X)=mx/n (X), где mx – масса вещества, г; n (X) – количество вещества, моль. Молярная масса вещества Х численно равна относительной молекулярной массе Mr (в случае молекул) или относительной атомной массе (в случае атомов).
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
- Например,Мr(СН4) = 16,043. Относительная молекулярная масса – величина безразмерная.
- Относительная атомная масса (Ar) –это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12.
- Например, Ar(Li) = 6,039.
Концентрация. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации. В России чаще всего концентрацию обозначают заглавной буквой С, имея в виду прежде всего массовую концентрацию, которая по праву считается наиболее часто применяемой в экологическом мониторинге форма выражения концентрации (именно в ней измеряют величины ПДК).
- Массовая концентрация (С или β) –отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (V). Это самая распространенная у российских аналитиков форма выражения концентрации.
- β(Х) =m (X) / V(смеси)
- Единица измерения массовой концентрации – кг/м 3 или г/м 3 , кг/дм 3 или г/дм 3 (г/л), кг/см 3 , или г/см 3 (г/мл), мкг/л или мкг/мл и т.д. Арифметические пересчеты из одних размерностей в другие не представляет большой сложности, но требуют внимательности. Например, массовая концентрация хлористоводородной (соляной) кислотыС(HCl) = 40 г / 1 л = 40 г/л = 0,04 г/мл = 4·10 – 5 мкг/л и т.д. Обозначение массовой концентрации С нельзя путать с обозначением мольной концентрации (с), которая рассматривается далее.
- Типичными являются соотношения β(Х): 1000 мкг/л = 1 мкг/мл = 0,001 мг/мл.
- Массовая концентрация — это отношение массы к объему системы . а отношение массы к массе это — массовая доля 🙂
Титр (Т) В объемном анализе (титриметрии) употребляется одна из форм массовой концентрации – титр.Титр раствора (Т) –это масса вещества, содержащегося в одном кубическом сантиметре = в одном миллилитре раствора.
- Единицы измерения титра — кг/см 3 , г/см 3 , г/мл и др.
Моляльность (b) —отношение количества растворенного вещества (в молях) к массе растворителя (в кг).
- b(Х) = n(X) / m (растворителя) = n(X) / m (R)
- Единица измерения моляльности —моль/кг. Например,b (HCl/H2O) = 2 моль/кг. Моляльная концентрация применяется в основном для концентрированных растворов.
Мольная(! )доля (х) –отношение количества вещества данного компонента (в молях), содержащегося в системе, к общему количеству вещества (в молях).
- х(Х) =n(X) / n(X) + n(Y)
- Мольнаядоля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных (млн –1 ,ppm), миллиардных (млрд –1 ,ppb), триллионных (трлн –1 ,ppt) и др. долях, но единицей измерения все равно является отношение –моль/моль. Например,х(С2Н6) = 2 моль / 2 моль + 3 моль = 0,4 (40 %).
Массовая доля (ω)–отношение массы данного компонента, содержащегося в системе, к общей массе этой системы.
- ω (Х) = m(X) / m(смеси)
- Массовая доля измеряется в отношениях кг/кг (г/г). При этом она может быть выражена в долях единицы, процентах (%), промилле, миллионных, миллиардных и т.д. долях. Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
- Например, условно ω (KCl) = 12 г / 12 г + 28 г = 0,3 (30%).
Объемная доля (φ) –отношение объема компонента, содержащегося в системе, к общему объему системы.
- φ (Х)=v(X) /v(X)+v(Y)
- Объемная доля измеряется в отношениях л/л или мл/мл и тоже может быть выражена в долях единицы, процентах, промилле, миллионных и т.д. долях. Например, объемная доля кислорода газовой смеси составляет φ (О2)=0,15 л / 0,15 л + 0,56 л.
Молярная (мольная) концентрация (с) –отношение количества вещества (в молях), содержащегося в системе (например, в растворе), к объему V этой системы.
- с(Х) = n(X)/ V(смеси)
- Единица измерения молярной концентрации моль/м 3 (дольная производная, СИ – моль/л).
- Например,c (H2S04) = 1 моль/л,с(КОН) = 0,5 моль/л.
- Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают как 1 М раствор (не надо путать эту букву М, стоящую после цифры, с ранее указанным обозначением молярной массы, т.е. количества вещества М). Соответственно раствор, имеющий концентрацию 0,5 моль/л, обозначают 0,5 М (полумолярный р-р); 0,1 моль/л – 0,1 М (децимолярный р.р); 0,01 моль/л – 0,01 М (сантимолярный р-р) и т.д.
- Эта форма выражения концентрации также очень часто применяется в аналитике.
Нормальная (эквивалентная) концентрация (N), молярная концентрация эквивалента(Сэкв.)– это отношение количества вещества эквивалента в растворе (моль) к объему этого раствора (л).
- N = Сэкв(Х) = n (1/Z X) / V(смеси)
- Количество вещества (в молях), в котором реагирующими частицами являются эквиваленты, называется количеством вещества эквивалента nэ(1/Z X) = nэ(Х).
- Единица измерения нормальной концентрации («нормальности») тоже моль/л (дольная производная, СИ).
- Например, Сэкв.(1/3 А1С13) = 1 моль/л.
- Раствор, в одном литре которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. Соответственно могут быть 0,5 н («пятидецинормальный»); 0,01 н (сантинормальный») и т.п. растворы.
- Следует отметить, что понятие эквивалентностиреагирующих веществ в химических реакциях является одним из базовых для аналитической химии. Именно на эквивалентности как правило основаны вычисления результатов химического анализа (особенно в титриметрии). Рассмотрим несколько связанных с этим базовых с т.з. теории аналитики понятий.
Фактор эквивалентности(fэкв)– число, обозначающее, какая доля реальной частицы веществ Х (например, молекулы вещества X) эквивалентна одному иону водорода (в данной кислотно-основной реакции) или одному электрону (в данной окислительно-восстановнтельной реакции) Фактор эквивалентности fэкв(Х) рассчитывают на основании стехиометрии (соотношении участвующих частиц) в конкретном химическом процессе:
- fэкв(Х) = 1/Zx
- где Zx.— число замещенных или присоединенных ионов водорода (для кислотно-основных реакций) или число отданных или принятых электронов (для окислительно-восстановительных реакций);
- Х — химическая формула вещества.
- Фактор эквивалентности всегда равен или меньше единицы. Будучи умноженным на относительную молекулярную массу, он дает значение эквивалентной массы (Е).
- Для реакции:
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- fэкв(H2SО4) = 1/2,fэкв(NaOH) = 1
- fэкв(H2SО4) = 1/2, т.е. это означает, что ½ молекулы серной кислоты дает для данной реакции 1 ион водорода (Н + ), а соответственноfэкв(NaOH) = 1 означает, что одна молекулаNaOHсоединяется в данной реакции с одним ионом водорода.
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- Для реакции:
- 10 FeSО4 + 2 KMnО4 + 8 H2SО4 = 5 Fe2(SО4)3 + 2 MnSО4 + K2SО4 + 8 H2О
- 2МпО4 — + 8Н + +5е — → Мп 2+ – 2e — + 4 Н2О
- 5 Fe 2+ – 2e — → Fe 3+
- fэкв(KMnО4) = 1/5 (кислая среда), т.е. 1/5 молекулы KMnО4 в данной реакции эквивалентна 1 электрону. При этомfэкв(Fe 2+ ) = 1, т.е. один ион железа (II) также эквивалентен 1 электрону.
- Для реакции:
Эквивалент вещества Х –реальная или условная частица, которая в данной кислотно-основной реакции эквивалентна одному нону водорода или в данной окислительно-восстановительной реакции – одному электрону.
- Форма записи эквивалента: fэкв(Х) Х (см. табл.), или упрощенно Эх, где Х –химическая формула вещества, т.е. [Эх =fэкв(Х) Х]. Эквивалент безразмерен.
- Эквивалент кислоты(или основания) – такая условная частица данного вещества, которая в данной реакции титрования высвобождает один ион водорода или соединяется с ним, или каким-либо другим образом эквивалентна ему.
- Например, для первой из вышеуказанных реакций эквивалент серной кислоты — это условная частица вида ½ H2SО4 т.е. fэкв(H2SО4) = 1/Z= ½; ЭH2SО4 = ½ H2SО4.
- Эквивалент окисляющегося(или восстанавливающегося)вещества— это такая условная частица данного вещества, которая в данной химической реакции может присоединять один электрон или высвобождать его, или быть каким-либо другим образом эквивалентна этому одному электрону.
- Например, при окислении перманганатом в кислой среде эквивалент марганцевокислого калия – это условная частица вида 1/5 КМпО4, т.е. ЭКМпО4 =1/5КМпО4.
- Так как эквивалент вещества может меняться в зависимости от реакции, в которой это вещество участвует, необходимо указывать соответствующую реакцию.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- эквивалент фосфорной кислоты Э Н3РО4 == 1 Н3РО4.
- Для реакции Н3РО4+ 2NaOH=Na2HPО4+ 2H2O
- ее эквивалент Э Н3РО4 == ½ Н3РО4,.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- Принимая во внимание, что понятие моляпозволяет пользоваться любыми видами условных частиц, можно дать понятиемолярной массы эквивалента веществаX. Напомним, что моль– это количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 12 г изотопа углерода 12 С (6,02 10 23 ). Под реальными частицами следует понимать атомы, ионы, молекулы, электроны и т.п., а под условными – такие как, например, 1/5 молекулы КМпО4в случае О/В реакции в кислой среде или ½ молекулы H2SО4 в реакции с гидроксидом натрия.
Молярная масса эквивалента вещества–масса одного моля эквивалентов этого вещества, равная произведению фактора эквивалентностиfэкв(Х) на молярную массу вещества М (Х) 1 .
- Молярную массу эквивалента обозначают как М [fэкв(Х) Х] или с учетом равенства Эх =fэкв(Х) Х ее обозначают М [Эх]:
- М (Эх)=fэкв(Х) М (Х); М [Эх] = М (Х) /Z
- Например, молярная масса эквивалента КМпО4
- М (ЭКМпО4) =1/5КМпО4 = М 1/5 КМпО4 = 31,6 г/моль.
- Это означает, что масса одного моля условных частиц вида 1/5КМпО4 составляет 31,6 г/моль. По аналогии молярная масса эквивалента серной кислоты М ½ H2SО4 = 49 г/моль; фосфорной кислоты М ½ H3 РО4 = 49 г/моль и т.д.
- В соответствии с требованиями Международной системы (СИ) именно молярная концентрацияя вляется основным способом выражения концентрации растворов, но как уже отмечалось, на практике чаще применяетсямассовая концентрация.
- Рассмотрим основные формулы и соотношения между способами выражения концентрации растворов (см. табл. 1 и 2).
Таблица 1 Основные способы выражения концентрации растворов
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 1. Массовая концентрация (С или β) | кг/м 3 | Производная (СИ) |
|
| кг/дм 3 | Дольная производная (СИ) | ||
| кг/л | Производная (внесистемная) | ||
| 2. Титр раствора (Т) | г/см 3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 3. Титр раствора А по определяемому компоненту Х | г/см 3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 4. Молярная концентрация,молярность(с) | моль/м 3 | Производная (СИ) |
|
| моль/дм 3 | Дольная производная (СИ) | ||
| моль/л | Производная (внесистемная) | ||
| 5. Молярная концентрация эквивалента (N), нормальность | моль/дм 3 | Производная (СИ) |
|
| моль/л | Производная (внесистемная) | ||
| 6. Моляльная концентрация,моляльность (b) | моль/кг | Производная (СИ) |
|
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 7. Мольная доля(х) | Относительная= моль/моль. (или в %, или в млн –1 ,ppm, в млрд –1 ,ppb, трлн –1 ,pptили в др. ед. | Безразмерная = 1 моль/моль = 1 = 100% = 10 6 млн -1 = 10 9 млрд -1 = 10 12 трлн -1 |
|
| 8. Массовая доля (ω) | Относительная= кг / кг. (или в %, или в млн –1 ,ppm, в млрд –1 ,ppb, трлн –1 ,ppt или в др. ед. | Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 10 6 млн -1 = 10 9 млрд -1 = 10 12 трлн -1 |
|
| 9. Объемная доля(φ) | Относительная= м3 /м3 (илил/л, илимл/мл, или в %, или в млн –1 ,ppm, в млрд –1 ,ppb, или в др. ед. | Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 10 6 млн -1 = 10 9 млрд -1 = 10 12 трлн -1 |
|
* В расчетных уравнениях химическую формулу обычно ставят в индексе.
Пересчеты из одной формы выражения концентрации в другую являются достаточно простыми арифметическими задачами, с решениями которых аналитику приходится сталкиваться очень часто – при приготовлении аналитических растворов, при пробоотборе и пробоподготовке, при смешении пробы с аналитическими растворами, а также при статистической обработке и представлении получившихся результатов в цифровой и графической форме. Рассмотрим формулы для пересчета шести наиболее часто применяемых форм выражения концентраций (см. табл. 2).
Таблица 2 Формулы перехода от одних выражений концентраций растворов к другим (процентная, в граммах на грамм растворителя, в граммах на грамм раствора, нормальная, молярная, моляльная) 6
- Обозначения:
- d-плотность раствора,
- W- молекулярный вес (масса) растворенного вещества,
- E- грамм-эквивалентный вес растворенного вещества
- Коровин Н.В., Мингулина Э.И., Рыжова Н.Г.Лабораторные работы по химии.Учеб. пособие для техн. направ. и спец. вузов. /Под ред. Н.В. Коровина. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1998. – с. 21–39.
- Жарский И.М., Кузьменко А.Л., Орехова С.Е.Лабораторный практикум по общей и неорганической химии./Под ред. Г.И. Новикова. – Мн.: Дизайн ПРО, 1998. – с. 3-27 и 46-56.
- Попадич И.А., Траубенберг С.Е, Осташенкова Н.В. и др..Аналитическая химия.Учебное пособие для техникумов. М.: Химия, 1989. – с. 91-98.
- Зайцев О.С.Исследовательский практикум по общей химии.Учебное пособие. М.: Изд-во МГУ, 1994. – с. 91-98.
- Лурье Ю.Ю.Справочник по аналитической химии.Справ. Изд. – 6-е изд., перераб. и доп. – М.: Химия, 1989. – с. 172-173.
Консультации и техническая
поддержка сайта: Zavarka Team

