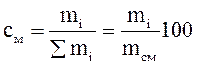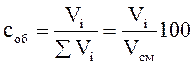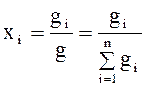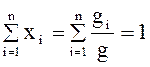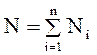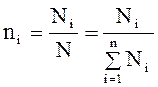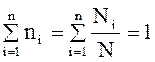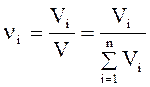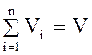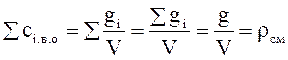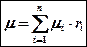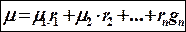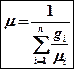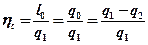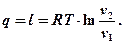Расчет концентрации. Массовый процент. Объемный процент. Концентрация газа при расчетах в химической технологии
Страницы работы
Содержание работы
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
Национальный исследовательский университет ресурсоэффективных технологий «ТПУ» (НИУ РЭТ ТПУ).
Химико-технологический факультет. Кафедра ТООС и ВМС.
Направление-24000 «Химия и биотехнология».
Лекционный курс-«Химия и технология органических веществ»
РАСЧЕТ КОНЦЕНТРАЦИИ 2
Массовый процент (см)- процентная доля массы вещества, содержащаяся в общей массе смеси веществ, т.е. указывает процент количества вещества в 100 г. смеси.
Объемный процент (соб)-процентная доля объема вещества, содержащаяся в общем объеме смеси веществ, т.е. указывает процент количества миллилитров вещества в 100 мл объема смеси.
Массовые доли. Если масса всего материального потока равна g, а масса содержащихся в ней компонентов gi(i=I, 2 n, где п— число компонентов в смеси), то массовые доли компонентов (массовые концентрации) определяются следующим образом;
Очевидно, что xi £ 1и
Мольные доли. Мольные доли компонентов смеси niопределяются как отношение числа молей данного компонента Ni,- к общему числу молей смеси
Объемная доля. Объемная доля vi; представляет собой отношение объема данного компонента Viпри заданном давлении к общему объему системы 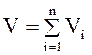
Если выполняется правило аддитивности объемов при смешении, т. е. если при смешении объемы отдельных компонентов не изменяются, то
и в этом случае сумма объемных долей также равна единице.
Необходимо отметить, что в аналитической, физической химии и в других областях применяются такие концентрации как нормальные, молярные, моляльные, титры и др., а также концентрации в частях по объему 1:V, где V— объем смеси, в котором содержится 1 объем данного газа (например, концентрация углекислоты 1:2000), а также дается объем газа, содержащийся в 1000 или 1000000 объемов смеси (например, концентрация озона 7 : 1000000).
Концентрацию газа при расчетах в химической технологии чаще всего выражают следующими способами:
· в весовых %(Св, % вес. или ww);
· массой газа в единице объема (Св0) (размерность кг/м 3 , г/м 3 и мг/дм 3 )- объемно-весовая концентрация;
· в объемных % (объемная концентрация С0, % об. или vol).
Понятие о весовых и объемных процентах даны на предыдущей странице. В аналитической химии, при расчетах массообменных процессов, в технике пыле- газоулавливания пользуются объемно-весовой концентрацией сi в.о представляющей собой отношение массы i-го компо-нента g; к объему смеси V = S Vi,-, т. е.
Если просуммировать объемно-весовая концентрации Св0 всех компонентов, то получим массу смеси в единице ее объема, т. е. плотность смеси рсм
Формулы пересчета концентраций для газа даны в таблице.
Кажущаяся молекулярная масса смеси
Плотность газа можно определить из соотношения

где m — молярная масса, vm — молярный объем газа.
Подставим это соотношение в формулу
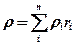
→ 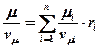
«При одинаковых температурах и давлениях килограмм-молекулы различных газов занимают одинаковые объемы» — следствие закона Авогадро. На его основании можно сократить vm и vmi . Получим:
Или, в развернутом виде:
Через массовые доли m можно определить по формуле:
Газовую смесь можно считать однородным газом с молекулярной
массой, рассчитанной по одной из этих формул. (Ее называют
Молекулярная масса воздуха, рассчитанная по приведенным
формулам, составляет 29 кг/кмоль.
Перевод массовых долей в объемные и обратно (без вывода)
массовые доли ‚ в объемные
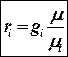
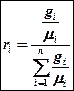
объемные доли ‚ в массовые
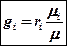

ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Сущность и формулировки
Принципиальная модель теплового двигателя
Второй закон имеет много формулировок. Некоторые из них:
Для получения из теплоты работы необходимо иметь разность температур. (С. Карно, 1824г.).
Теплота не может переходить от холодного тела к горячему самопроизвольно, то есть без затрат работы. (Р. Клаузиус, 1850г.).
Невозможно получение работы без перехода части теплоты от горячего источника к холодному. (В. Томсон, 1851г).
Все самопроизвольные процессы протекают в направлении от состояний менее вероятных к состояниям более вероятных. (Л. Больцман,1897г.).
Вечный двигатель второго рода невозможен.
Вечный двигатель второго рода– машина, которая не имеет источника холодного источника тепла и умеет извлекать работу из равновесной термодинамической системы. С помощью такой машины можно было бы превращать в работу внутреннюю энергию окружающей среды.
Теплота состоит из эксергии и анергии. (Современная формулировка)
Круговые процессы (циклы)
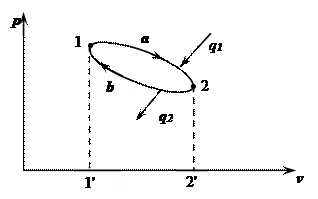
При протекании процесса расширения 1-а-2 совершается работа
Рабочее тело возвращается в исходное состояние процессом 2-b-1, на совершение которого затрачена работа:
Круговым процессом (циклом) называется совокупность двух или более процессов, возвращающих рабочее тело в исходное состояние.
Полезная работа цикла эквивалентна площади цикла в p-v координатах.
Цикл можно разбить на участки в зависимости от того, подводится или отводится тепло к рабочему телу:
q0 – полезное тепло цикла.
Очевидно, 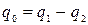
Запишем 1-й закон термодинамики для цикла:
Поскольку рабочее тело возвращается в исходное состояние, то Du0=0.
Отношение работы произведенной двигателем за цикл к количеству теплоты, подведенной за этот цикл называется термическим КПД.

ht определяет степень термодинамического совершенства цикла.
Циклы прямые и обратные,
обратимые и необратимые
Прямыми называются циклы, в которых процессы направлены по часовой стрелке, причем процессы расширение располагаются над процессами сжатия. (См. цикл выше.)
Полезная работа в цикле положительна, совершается за счет подводимой теплоты. По этим циклам работают тепловые двигатели.

Полезная работа в циклах отрицательна, компенсируется за счет притока энергии извне. По этим циклам работают холодильные установки.
Обратные циклы состоят из обратимых процессов. Необратимость одного процесса делает весь процесс необратимым.
Цикл Карно для идеального газа
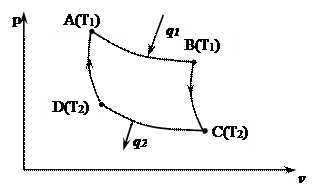
Цикл предложен в 1824г. французским ученым С. Карно. Он является идеальным циклом тепловых двигателей. Особенность цикла заключается в том, что тепло в нем подводится и отводится в изотермических процессах.
(AB) →изотермическое расширение с подводом теплоты q1;
(ВС) → адиабатное расширение;
(СD) →изотермическое сжатие с отводом теплоты q2;
(АD) → адиабатное сжатие.
Выведем формулу для определения к.п.д. цикла Карно htk .
Для изотермического процесса
Тогда тепло, подводимое и отводимое в цикле Карно, можно определить по аналогичным формулам:
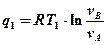
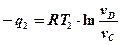

Подставим q1 и q2 в исходную формулу:
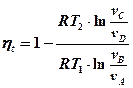
Докажем, что кроме газовой постоянной можно сократить и лога-рифмы. Для этого следует доказать, что подлогарифменные выражения равны.
Для адиабатных процессов BC и DA можно записать:
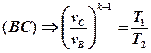
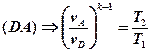
Второе выражение возведем в степень -1:
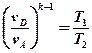
В выражениях (1) и (2) равны правые части. Следовательно, равны и левые:

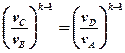
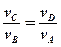

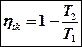
Свойства КПД Карно:
1. КПД не зависит от природы рабочего тела, а зависит от температур горячего и холодного источника тепла.
2. КПД увеличивается при увеличении перепада температур в цикле.
3. 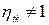
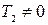

4. 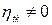
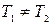
Цикл Карно на практике неосуществим, но он имеет большое научное значение, так как в любом конкретном интервале температур этот цикл дает максимально возможный КПД. (Докажем это утверждение позже.) Поэтому КПД цикла Карно служит эталоном для оценки степени совершенства любого цикла любого теплового двигателя.
Практическое значение цикла Карно состоит в том, что он указывает на необходимость увеличения Т1 и уменьшения Т2 для повышения КПД двигателя.
Обратный цикл Карно