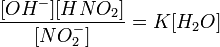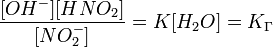Перевод ммоль в проценты
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная — на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с — процентная концентрация; M — молярная концентрация; N — нормальная концентрация; э — эквивалентная масса, p — плотность раствора; m — мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (c · p · 10) / m
N = (c · p · 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Пример
Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (12 · 1,08 · 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (12 ·1,08 ·10) / 49 = 2,64 H.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (N · Э) / m
N = (M · m) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,5· 53) / 106 = 0,25 M.
Упаривание, разбавление, концентрирование, смешивание растворов
Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью ρ1.
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
(где m1 – масса растворенного вещества в исходном растворе)
Пример
Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
m = 60 г; Dm = 60 – 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,05 · 60) / (60 – 10) = 3 / 50 = 0,06 (или 6%-ный)
Какую массу вещества (X г) надо дополнительно растворить в исходном растворе, чтобы приготовить раствор с массовой долей растворенного вещества w2?
Решение
Исходя из определения массовой доли, составим выражение для w1 и w2:
(где m1 – масса вещества в исходном растворе).
Решая полученное уравнение относительно х получаем:
Пример
Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным?
m = 90 г
w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 – 0,08) ·90) / (1 – 0,1) = (0,02 · 90) / 0,9 = 2 г
Перевод из грамм в число моль и из числа моль в граммы
Калькулятор выполняет перевод из массы вещества, заданной в граммах, в количество вещества в молях и обратно.
Для задач по химии бывает нужно перевести массу вещества в граммах в количество вещества в молях и обратно.
Решается это через простое соотношение:
,
где — масса вещества в граммах, — количество вещества в молях, — молярная масса вещества в грамм/моль
Калькулятор ниже автоматически вычисляет молярную массу по формуле вещества и рассчитывает массу вещества в граммах или количество вещества в молях, в зависимости от выбора пользователя. Для справки также выводится молярная масса соединения и детали ее расчета
Химические элементы следует писать так, как они написаны в таблице Менделеева, т. е. учитывать большие и маленькие буквы. Например Co — кобальт, CO — моноксид углерода, угарный газ. Таким образом, Na3PO4 — правильно, na3po4, NA3PO4 — неправильно.
Перевод из грамм в число молей и из числа молей в граммы
Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента, то есть масса атомов вещества взятых в количестве равном числу Авогадро (собственно, число Авогадро — это число атомов углерода-12 в 12 граммах углерода-12). Таким образом молярная масса элемента, выраженная в г/моль, численно совпадает с молекулярной массой — массой атома элемента, выраженной в а. е. м. (атомная единица массы). А молярные массы сложных молекул (химических соединений) можно определить, суммируя молярные массы входящих в них элементов.
И, собственно, самым сложным моментом в расчете является определение молярной массы химического соединения.
К счастью, на нашем сайте уже есть калькулятор Молярная масса соединений, который подсчитывает молярную массу химических соединений, основываясь на данных по атомной массе из справочника Таблица Менделеева. Он и используется, чтобы получить молярную массу по введенной формуле химического соединения в калькуляторе.
Внезапно русский язык
Теперь небольшое отступление. При написании этого текста у меня возник вопрос — как правильно писать с точки зрения русского языка: перевод молей в литры или перевод моль в литры.
Согласно викисловарю, слово моль склоняется, т.е. моль, моля, молю, моль, молем, моле в единственном числе, и моли, молей, молям, моли, молями, молях во множественном числе.
При этом согласно Методическому указанию от 1979 года Государственного комитета СССР по стандартам, «Обозначение единиц, совпадающих с наименованиями этих единиц, по падежам и числам изменять не следует, если они помещены после числовых значений, а также в заголовках граф, боковиков таблиц и выводов, в пояснениях обозначений величин к формулам. К таким обозначениям относятся: бар, бэр, вар, моль, рад. Следует писать 1 моль, 2 моль, 5 моль и т.д. Исключение составляет обозначение «св.год», которое изменяется следующим образом: 1 св.год, 2,3,4 св.года, 5 св.лет.»
Таким образом получается что «перевод молей в литры» — правильно, а «перевод моль в литры» — неправильно, но «5 моль» — правильно, «5 молей» — неправильно.
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная — на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с — процентная концентрация; M — молярная концентрация; N — нормальная концентрация; э — эквивалентная масса, r — плотность раствора; m — мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (c · p · 10) / m
N = (c · p · 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Пример
Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (12 · 1,08 · 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (12 ·1,08 ·10) / 49 = 2,64 H.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (N · Э) / m
N = (M · m) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,5· 53) / 106 = 0,25 M.
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2 . Образовался раствор (№3) с массовой долей растворенного вещества w3 . Как относятся друг к другу массы исходных растворов?
Решение
Пусть w1 > w2 , тогда w1 > w3 > w2 . Масса растворенного вещества в растворе №1 составляет w1 · m1, в растворе №2 – w2 · m2. Масса образовавшегося раствора (№3) – (m1 – m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
m1 / m2 = (w3 – w2) / (w1 – w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 – w3), w1 > w3 и (w3 – w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример
Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
13. теория электролитической диссоциации.
Теория электролитической диссоциации
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация — процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
Механизм электролитической диссоциации ионных веществ
При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Механизм электролитической диссоциации полярных веществ
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
Электролиты и неэлектролиты
Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю.
KCr(SO4)2 –– 1 • (+1) + 3 • (+3) + 2 • (-2) = +1 + 3 — 4 = 0
14. степень диссоциации. сильные и слабые электролиты. константа диссоциации.
Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
Они плохо (или почти не проводят) электрический ток.
Cu(OH)2 « [CuOH] + + OH — (первая ступень)
[CuOH] + « Cu 2+ + OH — (вторая ступень)
H2CO3 « H + + HCO — (первая ступень)
HCO3 — « H + + CO3 2- (вторая ступень)
Вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы.
Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Степень диссоциации. Константа диссоциации
Концентрация ионов в растворах зависит от того, насколько полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (c) и составу молекулы электролита (стехиометрическим индексам), например:
| c H2SO4 « | 2c c 2H + + SO4 2- |
Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации.
Степень диссоциации (a) — отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
и выражается в долях единицы или в % (a = 0,3 – условная граница деления на сильные и слабые электролиты).
Определите мольную концентрацию катионов и анионов в 0,01 М растворах KBr, NH4OH, Ba(OH)2, H2SO4 и CH3COOH.
Степень диссоциации слабых электролитов a = 0,3.
KBr, Ba(OH)2 и H2SO4 — сильные электролиты, диссоциирующие полностью (a = 1).
NH4OH и CH3COOH – слабые электролиты (a = 0,3)
[NH + 4] = [OH — ] = 0,3 • 0,01 = 0,003 M
[H + ] = [CH3COO — ] = 0,3 • 0,01 = 0,003 M
Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. гидратированных ионов.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации a и исходную концентрацию вещества c в растворе.
Определите концентрацию недиссоциированных молекул и ионов в 0,1 М раствора NH4OH, если степень диссоциации равна 0,01.
Концентрации молекул NH4OH, которые к моменту равновесия распадутся на ионы, будет равна ac. Концентрация ионов NH4 — и OH — — будет равна концентрации продиссоциированных молекул и равна ac (в соответствии с уравнением электролитической диссоциации)
| NH4OH | « | NH4 + | + | OH — |
| c — ac | ac | ac |
[N + H4] = [OH] — = ac = 0,01 • 0,1 = 0,001 моль/л
[NH4OH] = c — ac = 0,1 – 0,001 = 0,099 моль/л
Константа диссоциации (KD) — отношение произведения равновесных концентраций ионов в степени соответствующих стехиометрических коэффициентов к концентрации недиссоциированных молекул.
Она является константой равновесия процесса электролитической диссоциации; характеризует способность вещества распадаться на ионы: чем выше KD, тем больше концентрация ионов в растворе.
Диссоциации слабых многоосновных кислот или многокислотных оснований протекают по ступеням, соответственно для каждой ступени существует своя константа диссоциации:
15.ионное произведение воды. водородный показатель.
Вода является слабым электролитом и диссоциирует по уравнению: H2O ó H + + OH — . Выражение для
константы диссоциации имеет вид: Кдис = [H + ]рав [OH — ]рав =1,8 10 -16
Значение Кдис воды определили экспериментально по измерению удельной электропроводности при Т = 25 о С. Чистая вода практически не проводит электрический ток, т.е. άдис(H2O) + ] [OH — ] = 10 -14 , где Кw – ионное произведение воды.
В чистой воде [H + ] [OH — ] = 1 10 -14 , тогда [H + ] = [OH — ] = 10 -7 моль/л.
В водных растворах кислот [H + ] > [OH — ] или [H + ] > 7 моль/л, среда кислая.
В водных растворах щелочей и оснований [H + ] — ], [H + ] + ] [OH — ] = 1 10 -14 .
Для удобства выражения реакции среды водных растворов был введен специальный термин, который назвали водородным показателем (рН). рН – отрицательный десятичный логарифм молярной концентрации ионов водорода:
рН = — lg [H + ].
Иногда пользуются также показателем рОН – отрицательный десятичный логарифм молярной концентрации ионов гидроксила. рОН = — lg [ОH — ]
В нейтральной среде рН = 7 ; рОН = 7, рН + рОН = 14
В кислой среде рН 7 ; рОН 2H + + SO4 -2
Выражение для расчета рН: рН = -lg CM (H + ), где CM (H + ) = n (H + ) * άдис * CM (кислоты).
Рассчитаем CM (кислоты) = 0,245 / 98 * 0,5 = 0,05 моль/л
Тогда рН = -lg ( 1 * 2 * 0,05) = -lg 0,1 = 1.
Пример 2Рассчитайте рН 5,6% раствора КОН,степеньдиссоциации щелочи в растворе составляет 0,9. Плотность раствора равна 1,02 мл/л.
Решение: Уравнение диссоциации щелочи: КОН К + + ОН —
Выражение для расчета рН в растворах щелочей : рН = 14 – рОН = 14 – (-lg (ОH — ) * άдис *CM (КОН)).
Рассчитаем CM (КОН) = 12 * 1,02 / 56 * 0,1 = 1,02 моль/л
Тогда рН = 14 -lg ( 0,9 * 1 * 1,02) = 13.
16.гидролиз солей. (определение, типы)
Типы гидролиза солей
Химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора, называетсягидролизом солей.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Возможны 3 типа гидролиза солей.
Гидролиз по аниону идет, если соль образована катионом сильного основания и анионом слабой кислоты.
Например, соль СН3СООNa образована сильным основанием NaOH и слабой одноосновной кислотой СН3СООН. Гидролизу подвергается ион слабого электролита СН3СОО–.
Ионно-молекулярное уравнение гидролиза соли:
СН3СОО– + НОН « СН3СООН + ОН–
Ионы Н+ воды связываются с анионами СН3СОО– в слабый электролит СН3СООН, ионы ОН– накапливаются в растворе, создавая щелочную среду (рН>7).
Молекулярное уравнение гидролиза соли:
CH3COONa + H2O « CH3COOH + NaOH
Гидролиз солей многоосновных кислот протекает по стадиям, образуя в качестве промежуточных продуктов кислые соли.
Например, соль K2S образована сильным основанием КОН и слабой двухосновной кислотой H2S. Гидролиз этой соли протекает в две стадии.
1 стадия: S2– + HOH « HS– + OH–
K2S + H2O « KHS + KOH
2 стадия: HS-– + HOH « H2S + OH–
KHS + H2O « H2S + KOH
Реакция среды щелочная (pH>7), т.к. в растворе накапливаются ОН–-ионы. Гидролиз соли идет тем сильнее, чем меньше константа диссоциации образующейся при гидролизе слабой кислоты (табл.3). Таким образом, водные растворы солей, образованных сильным основанием и слабой кислотой, характеризуются щелочной реакцией среды.
Гидролиз по катиону идет, если соль образована катионом слабого основания и анионом сильной кислоты. Например, соль CuSO4 образована слабым двухкислотным основанием Cu(OH)2 и сильной кислотой H2SO4. Гидролиз идет по катиону Cu2+ и протекает в две стадии с образованием в качестве промежуточного продукта основной соли.
1 стадия: Cu2+ + HOH « CuOH+ + H+
2CuSO4 + 2H2O « (CuOH)2SO4 + H2SO4
2 стадия: CuOH+ + HOH « Cu(OH)2 + H+
(CuOH)2SO4 + 2H2O « 2Cu(OH)2 + H2SO4
Ионы водорода Н+ накапливаются в растворе, создавая кислую среду (рН [1] :
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
3. Гидролиз соли слабой кислоты и слабого основания:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
4. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции имеет вид:

Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 
Численное значение константы гидролиза получим, используя ионное произведение воды 

подставим в уравнение константы гидролиза:
В общем случае для соли, образованной слабой кислотой и сильным основанием:

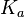
Для соли, образованной сильной кислотой и слабым основанием:


Для соли, образованной слабой кислотой и слабым основанием:
Гидролиз органических веществ
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например, в ходе гидролиза при участии пищеварительных ферментовбелки расщепляются на аминокислоты, жиры — на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — на моносахариды (например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
17.механизм окислительно-восстановительных реакций.
Окислительно-восстановительные свойства элементов.
Химические реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. В этих реакциях происходит обмен (перенос) электронов от одних реагирующих веществ к другим.
Степень окисления – условный заряд элемента в соединении, который вычисляется в предположении, что химические связи между элементами являются ионными. Заряды атомов кислорода принимают равными -2, в пероксидных соединениях – равным -1; заряд элементов первой группы +1, заряд атома водорода +1, а в гидридах металлов -1.
Принято обозначать степень окисления цифрой с указанием: «плюс», «минус».
В качестве примера окислительно-восстановительной реакции приведем уравнение реакции взаимодействия между H2S и HClO:
В приведенной реакции происходит понижение степени окисления окислителя (Cl + +2ē= Cl — ) и повышение степени окисления восстановителя
(S 2- -2 ē=S 0 ). В приведенном примере HClO является окислителем, а H2S- восстановителем.
Восстановитель — это частица, отдающая электрон, окислитель — принимающая электрон. Окисление — процесс отдачи электронов, восстановление — процесс приема электрона.
Окисление и восстановление – взаимосвязанные процессы, так как вещества могут отдавать электроны только в том случае, если в реакции участвует другое вещество, способное электроны принимать, что определяет закон сохранения заряда в химических реакциях.
Окислительные свойства могут проявлять как простые, так и сложные вещества. К типичным
(сильным) окислителям относятся фтор, галогены, кислород, а так же КClO3, НClO3, HNO3, H2SO4 (конц), MnO2, KMnO4, K2Cr2O7, PbO2 и др.
Восстановителями являются металлы, Н2, С (графит), HCl(конц), KI, KBr, H2S, CO, FeSO4.
Всегда восстановитель – это атом (частица) с максимально возможным числом электронов. Окислитель — это атом (частица) с минимально возможным числом электронов.
| Мn 0 | Мn +2 , Мn +3 , Мn +4 , Мn +5 , Мn +6 , | Мn +7 |
| всегда восстановитель | состояние атома в окислительно-восстановительной двойственности | всегда окислитель |
Есть вещества, способные проявлять и окислительные и восстановительные свойства. К ним относятся вещества, в состав которых входят атомы элементов в промежуточных степенях окисления. Под действием окислителей они могут повышать свою степень окисления, проявляя восстановительные свойства, а при реакциях с восстановителями – понижать степень окисления, проявляя окислительные свойства. К таким веществам относятся KNO2, H2O2, SO2, Na2SO3 и др.
Факторы, определяющие окислительно-восстановительные свойства элементов:
Природа атомов определяется положением элемента в периодической системе.
Для восстановителей характерен большой радиус, маленькая энергия ионизации. Энергия ионизации — энергия, которая затрачивается для отрыва электрона от атома. Для окислителей характерен малый радиус и большая энергия сродства к электрону.
Влияние кислотности среды. Например, KMnO4 универсальный окислитель, его окисляющая способность проявляется при любых условиях среды:
а) кислая среда, рН +7 +5ē→ Mn +2 (безцветный)
б) нейтральная среда, рН=7
Mn +7 +3ē→ Mn +4 (бурый)
в) щелочная среда, рН>7
Mn +7 +1ē→ Mn +6 (зеленый)
Расстановку коэффициентов в ОВР проводят по правилу электронного баланса: «Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем».
Эквиваленты окислителей и восстановителей
Понятие эквивалента в ОВР то же, что в реакциях обмена.
18.методы составления уравнений окислительно -восстановительных реакций.
Существуют два метода составления окислительно — восстановительных реакций — метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронного баланса.
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, приэтом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.
Расставить коэффициенты в реакции, схема которой: HCl + MnO2  Cl2 + MnCl2 + H2O Cl2 + MnCl2 + H2O |
| Алгоритм расстановки коэффициентов |
1.Указываем степени окисления химических элементов.  Подчёркнуты химические элементы, в которых изменились степени окисления. Подчёркнуты химические элементы, в которых изменились степени окисления. |
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.  За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно — 4.Следовательно и перед HCl ставим — 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент — 2. В результате получится химическое уравнение: За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно — 4.Следовательно и перед HCl ставим — 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент — 2. В результате получится химическое уравнение: 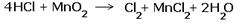 |
| Рассмотрим более сложное уравнение: |
H2S + KMnO4 + H2SO4  S + MnSO4 + K2SO4 + H2O S + MnSO4 + K2SO4 + H2O |
Расставляем степени окисления химических элементов:  |
Электронные уравнения примут следующий вид  Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции |
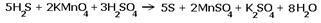 |
19. влияние реакции среды на характер протекания окислительно- восстановительных реакций.
Реакции окисления-восстановления могут протекать в различных средах: в кислой (избыток Н+- ионов), нейтральной (Н2О) и щелочной (избыток гидроксид-ионов ОН-). В зависимости от характера среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов.
Классическим примером, иллюстрирующим влияние среды на характер протекания окислительно-восстановительных реакций, является восстановление KMnO4. Перманганат калия является сильным окислителем, окислительная способность которого зависит от характера среды.
Наибольшую окислительную способность ионы Mn+7 проявляют в сильнокислой среде, восстанавливаясь до ионов Mn+2, несколько меньшую – в нейтральной или близкой к ней среде, в которой они восстанавливаются до MnO2, и минимальную – в сильнощелочной, восстанавливаясь до манганат-иона MnO4-2.
Схематически эти изменения можно изобразить так:
Окисленная форма Восстановленная форма
H+ Mn2+, бесцветный раствор


OH — MnO42+, раствор зеленого цвета
2 KMnO4 + 5 Na2SO3 + 3 H2SO4 = 2MnSO4 + 5 Na2SO4 + K2SO4 + 3 H2O
2 KMnO4 + 3 Na2SO3 + H2O = 2 MnO2↓ + 3 Na2SO4 + 2 KOH
2 KMnO4 + Na2SO3 + 2 KOH = 2 K2MnO4 + Na2SO4 + H2O
Для создания кислой среды используют разбавленную серную кислоту H2SO4.
Нежелательно использовать для этих целей соляную и особенно азотную, так как HCl в этих условиях будет проявлять восстановительные свойства, а HNO3 является окислителем. Для создания щелочной среды используют NaOH или KOH.
Количественной характеристикой среды является рН (водородный показатель), значение которого можно определить с помощью различных индикаторов.
Индикаторы –это вещества, которые в зависимости от среды изменяют свою окраску.
| Индикатор | Среда | ||
| Кислая | Нейтральная | Щелочная | |
| Лакмус | Розовый | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
20. основные положения координационной теории.
Для объяснения строения и свойств комплексных соединений в 1893 г. швейцарским химиком А Вернером была предложена координационная теория в которую он ввел два понятия: о координации и о побочной валентности.
По Вернеру главной валентностьюназывается валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории
валентности. Но, исчерпав главную валентность, атом способен, как правило, к дальнейшему присоединению за счет побочной валентности,в результате проявления которой и образуется комплексное соединение.
Под действием сил главной и побочной валентности атомы стремятся равномерно окружить себя ионами или молекулами и являются таким образом центром притяжения. Такие атомы называются центральными или комплексообразователями. Ионы или молекулы, непосредственно связанные с комплексообразователем, называютсялигандами.
Посредством главной валентности присоединяются лиганды ионы, а посредством побочной валентности – ионы и молекулы.
Притяжение лиганд к комплексообразователю называется координацией, а число лиганд – координационным числом комплексообразователя.
Можно сказать, что комплексные соединения это соединения, молекулы которых состоят из центрального атома (или иона) непосредственно связанного с определённым числом других молекул или ионов, называемых лигандами.
В роли комплексообразователей чаще всего выступают катионы металлов (Со +3 , Рt +4 ,Cr +3 ,Cu +2 Au +3 и др.)
В качестве лигандов могут выступать ионы Cl — ,CN — ,NCS — ,NO2 — ,OH — ,SO4 2- так и нейтральные молекулыNH3,H2O, амины, аминокислоты, спирты, тиоспирты, РН3, эфиры.