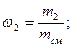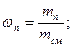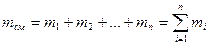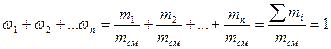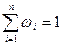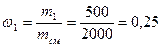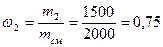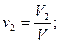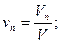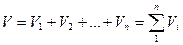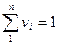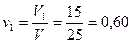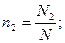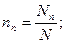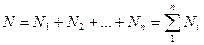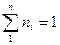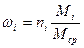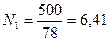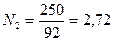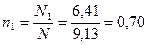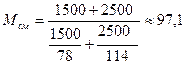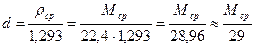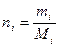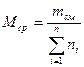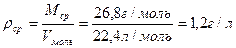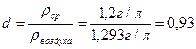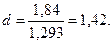Массовый, объемный и мольный состав
Смесь, состоящая из двух и более компонентов, характеризуется свойствами и содержанием этих компонентов. Состав смеси может быть задан массой, объемом, количеством (числом молей или килограмм-молей) отдельных компонентов, а также значениями их концентраций. Концентрацию компонента в смеси можно выразить в весовых, мольных и объемных долях или процентах, а также в других единицах.
Массовая доля wi какого-либо компонента определяется отношением массы mi данного компонента к массе всей смеси mсм:
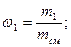
Учитывая, что суммарная масса смеси равна сумме масс отдельных компонентов, т.е.
Пример 4.Смесь состоит из двух компонентов: m1 = 500 кг, m2 = 1500 кг. Определить массовую долю каждого компонента в смеси.
Решение. Массовая доля первого компонента:
Массовая доля второго компонента:
Массовую долю второго компонента можно определить также, используя равенство:
Объемная доляni компонента в смеси равна отношению объема Vi данного компонента к объему всей смеси V:
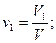
Пример 5. Газ состоит из двух компонентов: V1 = 15,2 м 3 метана и V2 = 9,8 м 3 этана. Подсчитать объемный состав смеси.
Решение. Общий объем смеси равен:
V = V1 + V2 = 15,2 + 9,8 = 25 м 3
Объемная доля в смеси:
метана
Мольная доляni какого-либо компонента смеси определяется как отношение числа киломолей Ni данного компонента к общему числу киломолей N смеси:
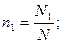
Учитывая, что:
получим:
Пересчет мольных долей в массовые можно проводить по формуле:
Пример 6. Смесь состоит из 500 кг бензола и 250 кг толуола. Определить мольный состав смеси.
Решение. Молекулярный вес бензола (С6Н6) равен 78, толуола (С7Н8) – 92. Число килограмм-молей равно:
бензола
толуола
общее число килограмм-молей:
Мольная доля бензола равна:
Для толуола мольная доля может быть найдена из равенства:
откуда: n2 = 1 – n1 = 1 – 0,70 = 0,30
Среднюю молекулярную массу смеси можно определить, зная мольную долю и молекулярную массу каждого компонента смеси:
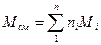
где ni — содержание компонентов в смеси, мол. доли; Mi — молекулярная масса компонента смеси.
Молекулярную массу смеси нескольких нефтяных фракций можно определить по формуле
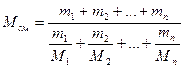
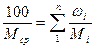
Молекулярную массу нефтепродукта можно определить также по формуле Крэга
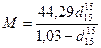
Пример 7. Определить среднюю молекулярную массу смеси бензола с изооктаном, если мольная доля бензола составляет 0,51, изооктана 0,49.
Решение. Молекулярная масса бензола 78, изооктана 114. Подставляя эти значения в формулу (21), получаем
Мср = 0,51 × 78 + 0,48×114 = 95,7
Пример 8. Смесь состоит из 1500кг бензола и 2500кг н-октана. Определить среднюю молекулярную массу смеси.
Решение. Используем формулу (22)
Объемный молярный состав пересчитывают в массовый следующим образом. Данный объемный (молярный) состав в процентах принимают за 100 молей. Тогда концентрация каждого компонента в процентах будет выражать число его молей. Затем число молей каждого компонента умножают на его молекулярную массу и получают массу каждого компонента в смеси. Разделив массу каждого компонента на общую массу, получают его массовую концентрацию.
Массовый состав пересчитывают в объемный (молярный) следующим образом. Принимают, что смеси взято 100 (г, кг, т) (если массовый состав выражен в процентах), массу каждого компонента делят на его молекулярную массу. Получают число молей. Делением числа молей каждого компонента на их общее число получают объемные (молярные) концентрации каждого компонента.
Средняя плотность газа определяется по формуле:
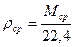
или, исходя из объемного состава:
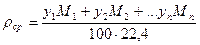
или, исходя из массового состава смеси:
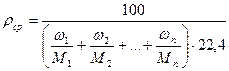
Относительную плотность определяют по формуле:
Пример 9. Пересчитать массовый состав газа в объемный и определить его молекулярную массу, его плотность и относительную плотность.
| Компоненты | М г/моль | массовый состав, % масс. | mi | Число молей  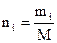 | Объемный состав |
| доли единицы | % об. | ||||
| Метан | 40:16=2,50 | 0,669 | 66,9 | ||
| Этан | 10:30=0,33 | 0,088 | 8,8 | ||
| Пропан | 15:44=0,34 | 0,091 | 9,1 | ||
| Бутан | 25:58=0,43 | 0,115 | 11,5 | ||
| Пентан + высшие | 10:72=0,14 | 0,037 | 3,7 | ||
| 3,74 | 1,000 | 100,0 |
Для простоты расчета примем массу смеси за 100 г, тогда масса каждого компонента будет численно совпадать с процентным составом. Найдем число молей ni каждого компонента. Для этого массу каждого компонента mi разделим на мольную массу:
Находим объемный состав смеси в долях единицы
wi(CH4) = 2,50 : 3,74 = 0,669; 



Находим объемный состав смеси в процентах, умножив данные в долях единицы на 100%. Все полученные данные заносим в таблицу.
Рассчитываем среднюю массу смеси.
Мср = 100 : 3,74 = 26,8 г/моль
Находим плотность смеси
Находим относительную плотность:
Пример 10. Пересчитать объемный состав в массовый и определить его молекулярную массу, его плотность и относительную плотность.
| Компоненты | М г/моль | Объемный состав, % об. | число молей ni | Масса компонента г. | Весовой состав |
| доли единицы | % масс. | ||||
| Метан | 30×16=480 | 0,117 | 11,7 | ||
| Этан | 15·30=450 | 0,109 | 10,9 | ||
| Пропан | 20·44=880 | 0,214 | 21,4 | ||
| Бутан | 15·58=870 | 0,211 | 21,1 | ||
| Пентан + высшие | 20·72=1440 | 0,349 | 34,9 | ||
| 1,000 | 100,0 |







Мср = 4120 : 100 = 41,2 г/моль.
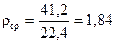
Задача 15. Смесь состоит из пяти компонентов. Определить массовую, объемную и мольную долю каждого компонента в смеси, среднюю молекулярную массу смеси.
| Компоненты смеси | Вариант | |
| mi (г) | mi (кг) | mi (т) |
| метан | ||
| этан | ||
| пропан | ||
| н-бутан | ||
| изобутан |
Задача 16. Пересчитать массовый состав газа в объемный и определить его молекулярную массу, плотность и относительную плотность по воздуху.
| Компоненты смеси | ω% массовый состав газа |
| Варианты | |
| метан | |
| этан | |
| пропан | |
| бутан | |
| пентан |
Задача 17. Пересчитать объемный состав газа в массовый и определить его молекулярную массу, плотность и относительную плотность по воздуху.
| Компоненты смеси | объемный состав газа ω% объем |
| Варианты | |
| метан | |
| этан | |
| пропан | |
| бутан | |
| пентан |
Дата добавления: 2014-12-24 ; Просмотров: 29433 ; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Концентрации и доли. Как перевести одну концентрацию в другую.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
где \Large w_ — массовая доля компонента i в смеси,
\Large m_ — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть \Large m_ по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
\Large m = m_<п>+m_<с>= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
\Large w_ <с>= \frac
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно \Large m_ <1>и \Large m_ <2>. Массу полученного после смешения раствора обозначим \Large m и найдём:
\Large m = m_ <1>+ m_ <2>= 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим \Large m_ <гл. 1>и \Large m_ <гл. 2>. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
\Large m_ <гл. 1>= w_<1>\cdot m_ <1>= 0.25 \cdot 200 г = 50 г
\Large m_ <гл. 2>= w_<2>\cdot m_ <2>= 0.1 \cdot 300 г = 30 г
Таким образом, общая масса глюкозы \Large m_ <гл>:
\Large m_ <гл>= m_ <гл. 1>+ m_ <гл. 2>= 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
где \Large \phi_ — объёмная доля компонента B;
\Large V_ — объём компонента B;
\Large \sum
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
где \Large x_ — мольная доля компонента B;
\Large n_ — количество компонента B, моль;
\Large \sum
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Затем считаем сумму количеств:
\Large \sum
И находим мольную долю каждого компонента:
\Large 40.68 \% + 11.86 \% + 47.46 \% = 100\%.
И радуемся правильному решению.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na + ] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
где \Large n_ — количество вещества компонента B, моль;
\Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
\Large c_
где \Large n_ — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности \Large f_
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Теперь считаем нормальную концентрацию:
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
где \Large n_ — количество вещества компонента B, моль;
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
где \Large m_ — масса растворенного вещества, г;
\Large V — общий объём смеси, л.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.