Перевод жидкого кислорода в газообразный формула
В процессах газопламенной обработки используют кислород в газообразном виде. Кислород в жидком виде применяют только при его хранении и транспортировке от завода-изготовителя до потребителей.
По внешнему виду жидкий кислород — голубоватая прозрачная подвижная жидкость, затвердевающая при -218,4°С и образующая кристаллы голубоватого цвета. Теплоемкость жидкого кислорода равна 1,69 кДж/(кг-°С) [0,406 ккал/(кг-°С)].
Перед подачей в сеть потребления для газопламенной обработки жидкий кислород подвергается испарению при заданном давлении в специальных устройствах — газификаторах, безнасосных или насосных. При испарении 1 дм 3 жидкого кислорода получается 0,86 м 3 , или 860 дм 3 газообразного кислорода (при 20°С и 760 мм рт. ст.); здесь 1,14 кг/дм 3 и 1,33 кг/м 3 соответственно плотности жидкого и газообразного кислорода. При испарении 1 кг жидкого кислорода образуется 1/1,33 = 0,75 м 3 газа (при 20°С и 760 мм рт. ст). Основные преимущества хранения и транспортировки кислорода в жидком виде следующие.
1. Сокращается (в среднем в 10 раз) масса тары и уменьшается требуемое количество баллонов и транспортных средств (автомобилей, вагонов), занятых на перевозке кислорода.
2. Отпадают расходы по организации и эксплуатации большого баллонного хозяйства на заводах (приобретение баллонов, постройка складов, учет, испытание и ремонт баллонов, транспортные расходы).
3. Повышается безопасность и упрощается обслуживание газопитания цехов газопламенной обработки, поскольку жидкий кислород хранится и транспортируется под небольшим давлением.
4. Получаемый при газификации жидкого кислорода газообразный кислород не содержит влаги, его можно транспортировать по трубопроводам при низких окружающих температурах без применения специальных мер против замерзания конденсата (прокладка труб ниже глубины промерзания, теплоизоляция, установка конденсатоотводчиков, прокладка паровых обогревателей и пр.).
Недостатком применения жидкого кислорода являются неизбежные потери его на испарение при хранении, перевозке и газификации.
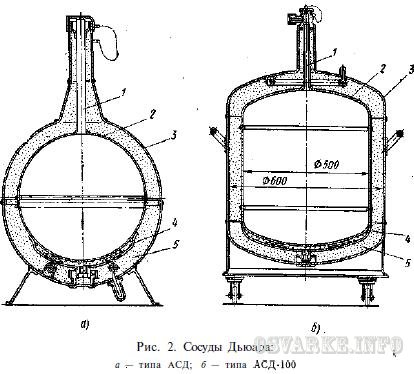
Для хранения и перевозки небольших количеств жидкого кислорода (азота, аргона, воздуха) используют сосуды Дьюара (рис. 2), шаровые (а) или цилиндрические (б). Сжиженный газ заполняет сосуд 2 из алюминиевого сплава, подвешенный на тонкостенной трубке — горловине 1 из стали Х18Н10Т внутри внешнего сосуда 3, изготовленного также из алюминиевого сплава. Все соединения выполнены аргонодуговой сваркой, стальные детали предварительно алитированы. Пространство между сосудами заполнено тепловой изоляцией 5 из смеси порошкообразного аэрогеля и бронзовой пудры.
В этом пространстве создан вакуум до остаточного давления (1 — 2) 10 -1 мм рт. ст. Снизу к внутреннему сосуду приварена камера 4, заполненная адсорбентом (силикагелем КСМ). При заполнении сосуда 2 сжиженным газом адсорбент охлаждается и поглощает остаточные газы в межстенном пространстве, создавая в нем вакуум до давления (1 — 5) 10 -3 мм рт. ст. Сталь Х18Н10Т обладает низким коэффициентом теплопроводности, вследствие чего теплоприток извне по горловине существенно снижен.
Транспортные резервуары используют для перевозки больших количеств жидкого кислорода (азота, аргона) автотранспортом и по железной дороге. Автомобильные резервуары имеют емкость 1000-7500 дм 3 , железнодорожные 30 000-35 000 дм 3 , а иногда и более.
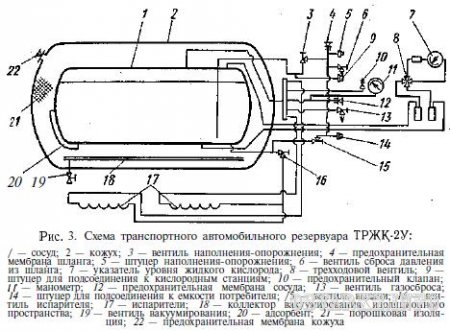
Типовой транспортный автомобильный резервуар ТРЖК-2У показан на рис. 3. Внутренний резервуар, в котором хранится жидкий кислород, изготовлен из стали Х18Н9Т аргонодуговой сваркой, наружный (кожух) — из низкоуглеродистой стали 20. Изоляция заполняющая межстенное пространство, — вакуумно-порошковая — из смеси аэрогеля с перлитовой пудрой; вакуум в межстенном пространстве соответствует остаточному давлению 5*10 -2 мм рт. ст.
Заполнение резервуара жидким кислородом из стационарной емкости производится через вентиль 3 и штуцер 5 при открытом вентиле 13 для сброса газа в газгольдер или атмосферу. При опорожнении резервуара в нем создается избыточное давление до 0,1 — 0,15 МПа (1-1,5 кгс/см 2 ) за счет испарения части жидкого кислорода в испарителях 17. Слив жидкости производится также через вентиль 3 и штуцер 5 при закрытом вентиле 13. Для уменьшения притока теплоты через опоры резервуара они изготовлены из слоистого стеклопластика, обладающего низким коэффициентом теплопроводности и достаточной прочностью при низких температурах.
Для превращения жидкого кислорода в газообразный служат газификационные установки. Их производительность достигает 15—20 м 3 /ч. Применяют два типа газификационных установок: насосные и безнасосные.
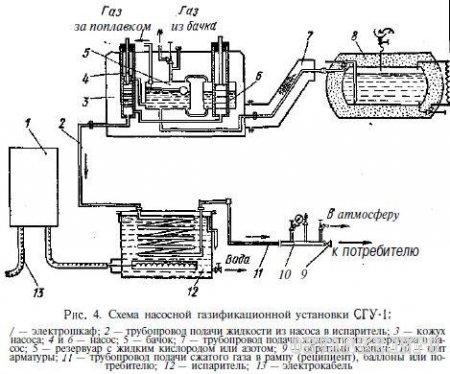
Насосная газификационная установка СГУ-1, показанная на рис. 4, предназначена для газификации непереохлажденного кислорода и наполнения баллонов (реципиентов газообразным кислородом под давлением до 24 МПа (240 кгс/см 2 ). Кислород от реципиентов подается по трубопроводу к местам потребления через центральный рамповый редуктор под требуемым давлением порядка 1,2-2 МПа (15-20 кгс/см 2 ) для процессов газопламенной обработки. Имеются газификационные станции, насосы которых рассчитаны на давление 20 МПа (200 кгс/см 2 ) и служат для подачи кислорода в сеть через буферную емкость. В промышленности применяют также автомобильные передвижные газификационные установки.
Безнасосные газификаторы имеют рабочее давление до 1,6 МПа (16 кгс/см 2 ) при относительно постоянном и равномерном расходе кислорода, подаваемого по трубопроводу к местам потребления (рис. 5). Сосуд газификатора снабжен вакуумно-порошковой изоляцией и рассчитан на максимальное рабочее давление.
Первоначально давление в сосуде создается испарением кислорода в испарителе 9 и автоматически поддерживается постоянным регулятором 2. В зависимости от расхода газа жидкий кислород через регулятор 8 поступает в испаритель 7 и затем в виде газа идет в трубопровод к потребителю. Избыток газа в газификаторе сбрасывается при заданном давлении также в трубопровод потребителя через регулятор 3. Сосуд 1 наполняется жидким кислородом через штуцер 4 и вентили 5 и 6.
Жидкий кислород, медицинский кислород
Газообразный кислород сегодня в промышленных масштабах получают из атмосферного воздуха. Его производство актуально и востребовано в наши дни. Существует специальное оборудование, которое позволяет получать кислород в необходимых объемах. В условиях лаборатории газообразный (а затем и жидкий) кислород наиболее часто получают, используя возможности электролиза водных растворов щелочей. Также существует еще один способ получения небольшого количество кислорода — взаимодействие подкисленного раствора пероксида водорода и раствора перманганата калия. Газообразный кислород сегодня востребован во множестве профессиональных видов деятельности человека.
Сферы применения кислорода
Основные химические свойства кислорода:
- способствует протеканию процессов дыхания, горения, гниения;
- является сильным окислителем, но не воздействует на Au и Pt;
- взаимодействует со всеми HeMe, кроме галогенов, за исключением F.
Такие характеристики данного газа обусловили его использование сегодня в самых разнообразных технологических процессах. Любое оборудование для проведения газопламенных работ не может функционировать без кислорода. К газопламенным работам относятся:
- пайка металлов,
- газовая сварка,
- резка металла.
В металлургической промышленности использование газообразного кислорода позволяет ощутимо повысить эффективность производства. Кислород технический в работе с металлом востребован в достаточно значительной степени. Без его использования многие виды работ попросту невозможны. Так, кислород технический позволяет повысить температуру горения. Он широко используется в производстве цветных и черных металлов.
Также он широко применяется в химической, нефтехимической и нефтегазовой промышленности. Применение кислорода помогает повысить производительность предприятий, занимающихся выращиванием рыбы и морепродуктов. В стекольной промышленности и при утилизации отходов данный газ также востребован.
Кислород участвует в окислительно-восстановительных реакциях, широко применяется в медицине. Медицинский кислород востребован в медицинских учреждениях. Так, аппараты искусственного дыхания используют медицинский кислород в чистом виде или же в качестве одной из составляющих воздушной смеси. Современное оборудование помогает производить сложнейшие операции и восстанавливать человеческое здоровье, казалось бы, в безнадежных ситуациях.
Жидкий кислород удобен в хранении на складе и транспортировке. Перед использованием его извлекают со склада и посредством специального процесса газификации жидкий кислород переводят в газообразное состояние.
Справка
Кислород — химический элемент с атомным номером 8, обозначающийся символом О, а также вещество (газ при нормальных условиях), молекула которого состоит из двух атомов кислорода (O2). Кислород является самым лёгким элементом из группы халькогенидов (6 группа периодической системы).
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (возможно, в 1770-м) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. [Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теории флогистона.]
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Название oxygenium («кислород») происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с первоначальным значением термина «кислота». Ранее этим термином называли оксиды.
Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объёму) в воздухе массовая доля кислорода состовляет 23,12 % . Элемент кислород входит в состав более 1500 соединений земной коры.
Получение
В настоящее время в промышленности жидкий кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода.
Физические свойства
Газ без цвета, вкуса и запаха. Растворим в воде, причем растворяется тем лучше, чем ниже ее температура. Поэтому плотность живых организмов в холодных приполярных водах может быть значительно выше, чем в теплых экваториальных.
Химические свойства
- Сильный окислитель, но не окисляет Au и Pt
- Взаимодействует со всеми HeMe, кроме галогенов, за исключением F
- Поддерживает процессы дыхания, горения, гниения
Биологическая роль кислорода
Кислород участвует в окислительно-восстановительных реакциях. Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечнососудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Компания «СнабТехГаз» предлагает оборудование для производства азота и технического кислорода
КАК ЖИДКИЙ КИСЛОРОД СНОВА ПРЕВРАЩАЮТ В ГАЗ
ДДы рассмотрели несколько примеров применения *** жидкого кислорода. Однако ещё больше промышленность нуждается в газообразном кислороде.
Газообразный кислород можно получать непосредственно на установках глубокого холода. Но не во всех случаях это бывает выгодно. Часто потребители предпочитают привозить жидкий кислород с кислородного завода и уже на месте потребления превращать его в газ.
Возьмём, например, весьма распространённую в промышленности сварку и резку металлов. Газообразный кислород поступает к месту сварочных работ в специальных баллонах. Объём такого баллона не превышает обычно 40—60 литров. Чтобы поместить в баллоне возможно больше газообразного кислорода, последний сжимают до 150 атмосфер. При таком давлении 40-литровый баллон вмешает уже шесть кубических метров газообразного кислорода.
Баллоны для перевозки сжатых газов должны быть очень прочными. Они делаются из массивных стальных труб, изготовленных без шва. Сталь для труб должна быть высокого качества, и баллоны эти обходятся очень дорого. Пустой 40-лит]повый баллон весит около 80 килограммов— в 9 рае больше, чем помещаемый в него газ. Представьте себе, что кислооод нужно перечоз-ить на значительные расстояния Здесь-то и скажутся преимущества жидкого кислорода.
Тысяча кубометров газообразного кислорода весит менее полутора тонн. Чтобы вместить столько газа, потребуется 167 баллонов общим весом в. 13 тонн. Для перевозки их придётся занять целую железнодорожную платформу или 9 грузовиков-полуторатоннок.
Другое дело — перевозка жидкого кислорода. Полторы тонны его свободно помещаются в лёгком резервуаре объёмом всего в 1300 литров й перевозятся одним грузовиком.
Однако экономией на перевозке преимущества жидкого кислорода не ограничиваются. Жидкий кислород не содержит влаги, которая обычно есть в газе. Отсутствие влаги значительно улучшает качество сварочных работ, для которых используется кислород.
Правда, перевозка жидкого кислорода тоже не свободна от недостатков. Жидкий кислород непрерывно испаряется. Однако с этим недостатком можно бороться. Цистерны для жидкого кислорода снабжаются компрессорами, которые накачивают испаряющийся газ в баллоны. Но даже в тех случаях, когда жидкий кислород просто испаряется в атмосферу, перевозить его на дальние расстояния гораздо выгоднее, чем газообразный.
Как же жидкий кислород снова превращают в газ? Для этого применяются особые аппараты — газификаторы. Жидкий кислород, налитый в резервуар такого аппарата, быстро испаряется и под давлением в 10—15 атмосфер идёт по трубам к месту сварки.
Существуют специальные газификаторы, в которых давление испаряющегося газа повышается до 150 атмосфер. Эти газификаторы служат для быстрого наполнения кислородом знакомых нам баллонов.