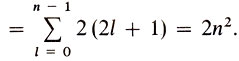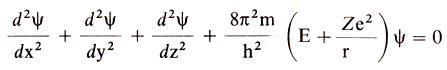Понятие атом в переводе с греческого означает
В переводе с греческого слово «атом» означает «неделимый». На протяжении многих столетий атом считали пределом делимости материи. В XIX в. ученые уже могли определить относительные атомные массы химических элементов, хотя никто из них не знал, как устроен атом.
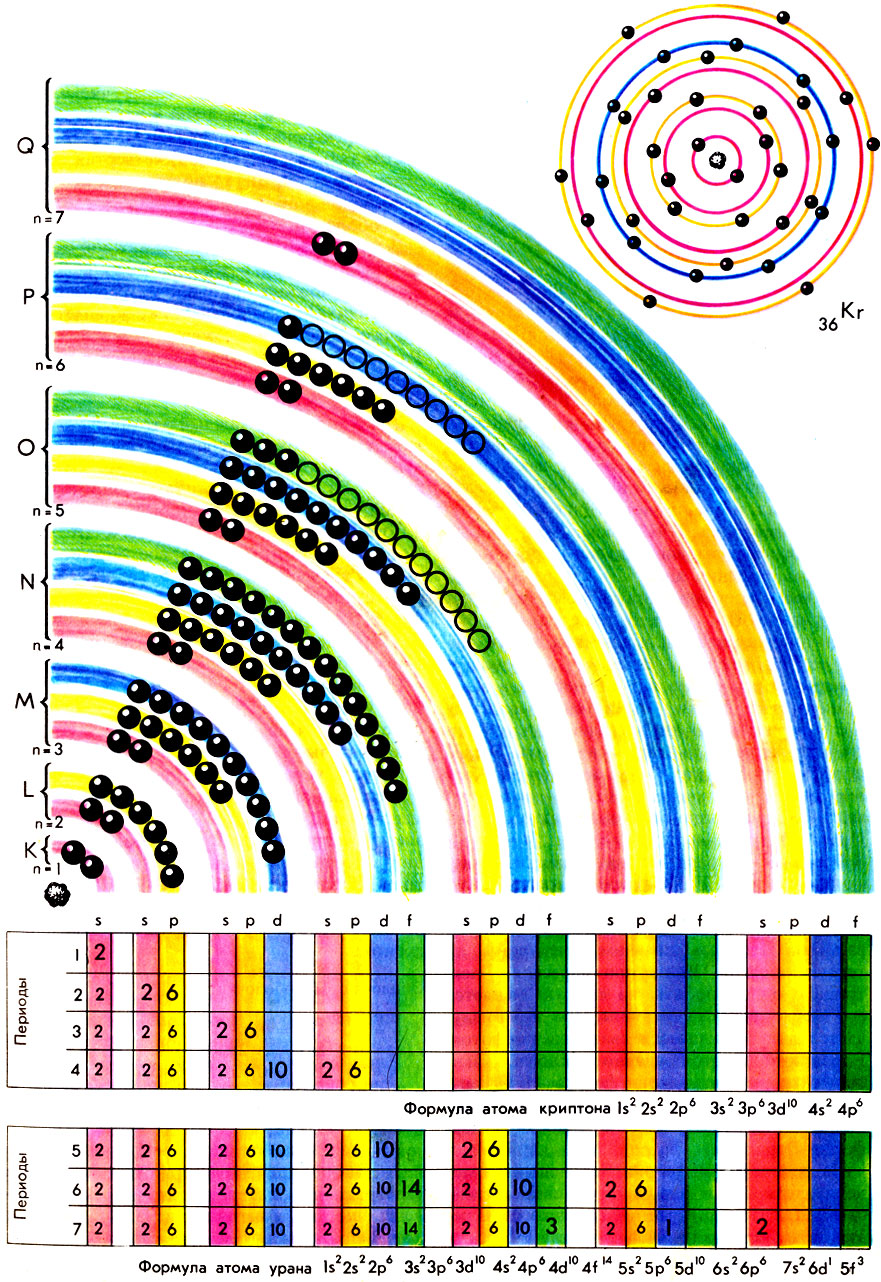
Структура атомов урана и криптона
Лишь когда был открыт электрон (1897), возникли предположения, что именно из электронов состоят все атомы. Появилось несколько моделей «электронного» строения атомов. Но они не давали ответа на кардинальный вопрос: что же служит носителем положительного электричества в атоме? Ведь атом в целом электронейтрален.
Современную модель строения атома предложил в 1911 г. Э. Резерфорд. Она получила название ядерной, или планетарной. По Резерфорду, в центре атома находится положительно заряженное ядро. В нем сосредоточена почти вся масса атома. Вокруг ядра, подобно планетам вокруг Солнца, вращаются электроны. Ученые не сразу смогли сделать определенный вывод о том, как устроено ядро. Сначала полагали, что оно состоит из протонов и электронов. Только после открытия нейтрона (1932) советский ученый Д.Д. Иваненко выдвинул идею о протон-нейтронном строении ядра.
Модель Резерфорда наука сразу взяла на вооружение. Но у нее был недостаток, настолько существенный, что ставил под сомнение ее правомерность. Вращаясь вокруг ядра, электроны постоянно теряли энергию и в конечном счете должны были упасть на ядро. Так утверждали законы классической механики, а их никто не пытался оспаривать. Таким образом, любой атом рано или поздно был обречен на уничтожение. Но это противоречило представлению об атомах как об устойчивых материальных структурах.
На основе своей теории Бор построил модели атомов всех элементов и связал свойства элементов со строением их атомов. В результате была найдена физическая сущность явления периодического изменения свойств химических элементов и разработана теория их периодической системы.
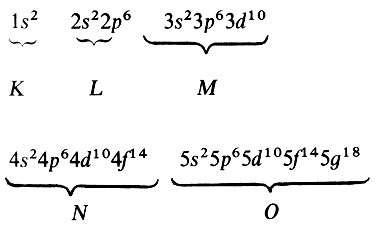
В свою очередь, электроны каждой оболочки группируются в подоболочки, причем число возможных подоболочек равно номеру оболочки. Подоболочки также принято обозначать латинскими буквами s, р, d, f, g и др. Разумеется, количества электронов в подоболочках ограниченны: они равны соответственно 2, 6, 10, 14, 18.
Соотношения между оболочками и подоболочками просто иллюстрируются следующей схемой:
В 1925 г. швейцарский физик В. Паули сформулировал правило, носящее название принципа Паули: в атоме не может быть двух электронов, характеризующихся одинаковыми значениями четырех квантовых чисел. Этот принцип и позволил четко объяснить емкость электронных оболочек и подоболочек: Nl (число электронов в подоболочках) = 2 (2l + 1), а Nn (число электронов в оболочке)
В каком порядке происходит заполнение электронных оболочек и подоболочек атомов? Казалось бы, наиболее простой и логичный вариант следующий: по мере роста заряда ядра Z последовательно до полной емкости заполняются электронные оболочки, согласно увеличивающимся значения главных квантовых чисел.
Иными словами, записанная на «электронном» языке схема заполнения должна была бы выглядеть так:
Следствием реальной схемы оказывается структура периодической системы химических элементов.
Изображение атомов урана (светлые пятна) на тонкой подложке из углерода (при увеличении в 7,5 млн. раз). Микрофотография получена с помощью микроскопа с атомным разрешением
Почему природа отдала предпочтение реальной схеме перед идеальной? Однозначного строго обоснованного объяснения, пожалуй, нет до сих пор. Правда, более или менее удовлетворительный ответ был найден, когда к объяснению модели атома были применены представления квантовой механики.
В основе квантовой механики лежит идея, что электрон наряду с материальными свойствами обладает и волновыми, т.е. он одновременно является и частицей, и волной. Поэтому его поведение в атоме может быть описано с помощью волнового уравнения, которое вывел в 1926 г. австрийский физик Э. Шредингер. Математики называют его дифференциальным уравнением второго порядка в частных производных:
Что же касается величины ψ, то она представляет собой так называемую волновую функцию. Она не измеряется ни в граммах, ни в сантиметрах, ни в секундах. Это отвлеченная величина, характеризующая степень вероятности того, что данный электрон находится в определенном участке пространства, окружающего ядро. Если ψ = 1, то, значит, электрон располагается на некотором определенном месте; если же ψ = 0, то, следовательно, в этом месте электрона нет. Представление о вероятности нахождения электрона на данном участке околоядерного пространства является главным в квантовомеханической модели атома.
Поэтому в такой модели нет определенных электронных орбит, столь четко очерченных Бором в его модели атома. Электроны как бы размазаны в пространстве в виде некоторого электронного облака. Большей плотности облака соответствует большая вероятность нахождения электрона.
Хотя квантовомеханическая модель атома сложна, но она лежит в основе современных теорий химической связи, являясь их строгой физической основой. С другой стороны, решение уравнения Шредингера позволяет вывести последовательность формирования электронных конфигураций атомов по мере роста Z. Оказывается, волновая функция связана с тремя величинами, которые могут принимать только целочисленные значения. И эти величины не что иное, как главное, орбитальное и магнитное квантовые числа.
Преимущество квантовомеханической модели атома перед моделью Бора в том, что она основана на строгих физических закономерностях. Но и модель Бора не утратила своего значения, ведь именно ею пользуются до сих пор при объяснении основных закономерностей периодического изменения свойств химических элементов.
Значение слова «атом»
[От греч. ’άτομος — неделимый]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам.
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий). Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
А’ТОМ, а, м. [греч. atomos, букв. неделимый]. Мельчайшая частица материи (в атомистической теории предполагалась неделимой; ест.). Молекула воды состоит из двух атомов водорода и одного атома кислорода. || перен. Ничтожная величина, одна из многих незначительных частей какого-н. целого (книжн.).
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
а́том I
1. физ. хим. мельчайшая частица химического элемента ◆ Атом водорода. ◆ Атом железа. ◆ Разлагать молекулу на атомы.
2. матем. в математической логике — простейший случай формулы; формула, которую нельзя расчленить на подформулы
3. матем. в теории меры — измеримое множество положительной меры, которое не содержит в себе подмножества меньшей положительной меры
Фразеологизмы и устойчивые сочетания
Делаем Карту слов лучше вместе

Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова хулительный (прилагательное):
Атомы, ионы, молекулы
Атом и его строение
Над тем, как устроено вещество, люди размышляли с глубокой древности. Античные греческие ученые предполагали, что вещества состоят из мельчайших, невидимых глазу частиц разной формы, которые соединяются друг с другом при помощи различных крючков и присосок. Слово «атом» в переводе с греческого означает «неделимый». Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад электронов в массу атома крайне мал. Масса электрона составляет 9,1 · 10−31 кг.
Каждый электрон заряжен отрицательно, условно его заряд принимают равным –1. Символ, которым принято обозначать электрон – ē. Электроны движутся вокруг ядра, перемещаясь по сложным траекториям. Ядро атома состоит из двух типов частиц: протонов и нейтронов. Протоны обозначают буквой р, а нейтроны – n.
В целом атом электронейтрален, то есть его заряд равен нулю. С учетом электронейтральности атома, количество электронов в атоме всегда совпадает с количеством протонов. С учетом того, что в ядре только протоны заряжены (нейтроны заряда не имеют), и заряд каждого протона +1, ядро имеет заряд. Заряд ядра определяется количеством протонов, и всегда имеет знак + Заряд ядра обозначают символом Z (протонное число) Как определить количество электронов и протонов в атоме? На приведена схема строения атома водорода. Видно, что атом водорода состоит из одного отрицательно заряженного электрона и положительно заряженного ядра, состоящего из одного протона.
Количество электронов и протонов в атоме химического элемента совпадает с его порядковым номером Рассмотрим другой пример. Определим количество электронов, протонов и заряд ядра для атома кислорода. Порядковый номер кислорода – 8.
Значит, в его атоме содержится 8 электронов, 8 протонов, заряд ядра +8. Как определить количество нейтронов?
В начале параграфа уже упоминалось, что практически вся масса атома сосредоточена в его ядре. В свою очередь ядро состоит из протонов и нейтронов. Относительная атомная масса элемента, записанная в Периодической Системе, приблизительно равна сумма масс протонов и нейтронов, поскольку масса электронов очень мала. Сумму масс протонов и нейтронов, равную округленной атомной массе химического элемента, называют массовым (нуклонным) числом и обозначают А. Определим количество нейтронов в атоме кислорода.
Относительная атомная масса кислорода с учетом округления равна 16. Вычтем количество протонов: 16 – 8 = 8. В атоме кислорода 8 нейтронов.
С учетом вышесказанного можем записать несколько простых выражений:
Атом – мельчайшая частица вещества, состоящая из ядра и электронов, движущихся в околоядерном пространстве Протоны и нейтроны имеют общее название – нуклоны (от лат. nucleus – «ядро»).
Термином нуклид обозначают атом с определённым порядковым номером Z и массовым числом А, т.е. с определённым набором протонов и нейтронов. Нуклиды с одним и тем же атомным номером, но с разными массовыми числами называются изотопными нуклидами или просто изотопами (от греч. «изос» – «равный» и «топос» – «место»).
Другими словами, в ядрах всех изотопов данного элемента содержится одинаковое число протонов, но разное число нейтронов. Нуклиды обозначают символом элемента и массовым
Если массовое число не указывать, то подразумеваются все природные изотопы данного элемента. Иногда указывают и атомный номер элемента, но это не обязательно, поскольку символ элемента однозначно связан с определённым Z.
Так, для атомов водорода Z = 1, для азота Z = 7, для кислорода Z = 8 и т.д. Разных нуклидов значительно больше, чем элементов. Например, в природе найдены три изотопа водорода – нуклиды 1Н, 2Н (другое обозначение D – дейтерий) и 3Н (или Т – тритий), три изотопа углерода (12С, 13С и 14С), четыре – серы, пять – кальция, шесть – селена, семь – молибдена, восемь – кадмия, девять – ксенона и десять – олова (это рекорд).
Есть и элементы одиночки, представленные всего одним нуклидом: 9Ве, 19F, 23Na, 27Al, 31P и др. Некоторые природные нуклиды нестабильны: со временем они распадаются; это – радионуклиды.
Ионы
В отличие от атомов, ионы – это заряженные частицы. Ионы образуются в том случае, если нейтральный атом «потеряет» или «приобретет» часть электронов. Например, в результате некоторой реакции, атом натрия утратил один электрон. Обратимся к Периодической Системе, согласно которой узнаем, что в атоме натрия 11 электронов. Если один электрон покинет атом, их останется 10, тогда нарушится принцип электронейтральности атома и положительно заряженное ядро будет доминировать, то есть частица приобретет положительный заряд. Частица Na+ и есть ион. Возможен и другой вариант, атом, в результате химической реакции, может присоединять электроны. В этом случае образуется избыток электронов и, следовательно, суммарный отрицательный заряд электронов больше, чем положительный заряд ядра. Такой ион будет заряжен отрицательно.
Молекулы
Из курса природоведения вам известно, что молекулы образуются из атомов посредством их взаимодействия в результате химических реакций. Например, молекула водорода Н2, образуется при взаимодействии двух атомов водорода. Молекула – наименьшая частица вещества, обладающая его химическими свойствами, состоящая из двух или более атомов Подобно молекулам водорода образуются и другие молекулы, например: молекула азота N2, кислорода О2, хлора Cl2 и другие молекулы. Конечно же, существуют и более сложные молекулы, состоящие из большего числа атомов. Например, сладкий вкус фруктам придает глюкоза. Существуют очень большие молекулы, в состав которых входят десятки, сотни и даже тысячи атомов! Например, молекулы белков, из которых состоят все живые организмы, состоят из сотен и тысяч различных атомов!
Атомно-молекулярная теория
Процесс познания складывается таким образом, что блестящие догадки и великие теории, являвшиеся в свое время результатом гениального творчества, через более или менее продолжительное время становятся едва ли не тривиальными фактами, которые большинство людей принимает на веру. Многие ли из нас могли бы самостоятельно, на основе наблюдений и размышлений, догадаться, что Земля круглая, или что Земля вращается вокруг Солнца, а не наоборот, и наконец, что существуют атомы и молекулы? С высоты современной науки основные положения атомно-молекулярной теории выглядят всем известными положениями.
Но для ученых прошлого, пытавшихся решить два основных вопроса:
Результатом стала атомно- молекулярная теория, основные положения которой можно сформулировать следующим образом:
Вывод из статьи про Атомы, ионы, молекулы